生物学:セマフォリンは2つのTOR複合体の制御を通じて細胞を変化させる
- ツイート
- 2011/10/27
名古屋大学大学院理学研究科の高木 新 准教授らの研究グループは、シグナル分子セマフォリンが、二種類のTOR複合体形成の切り替えを通じて、細胞内のタンパク質の翻訳や細胞骨格を調節し、細胞の形態変化を制御することを明らかにした。
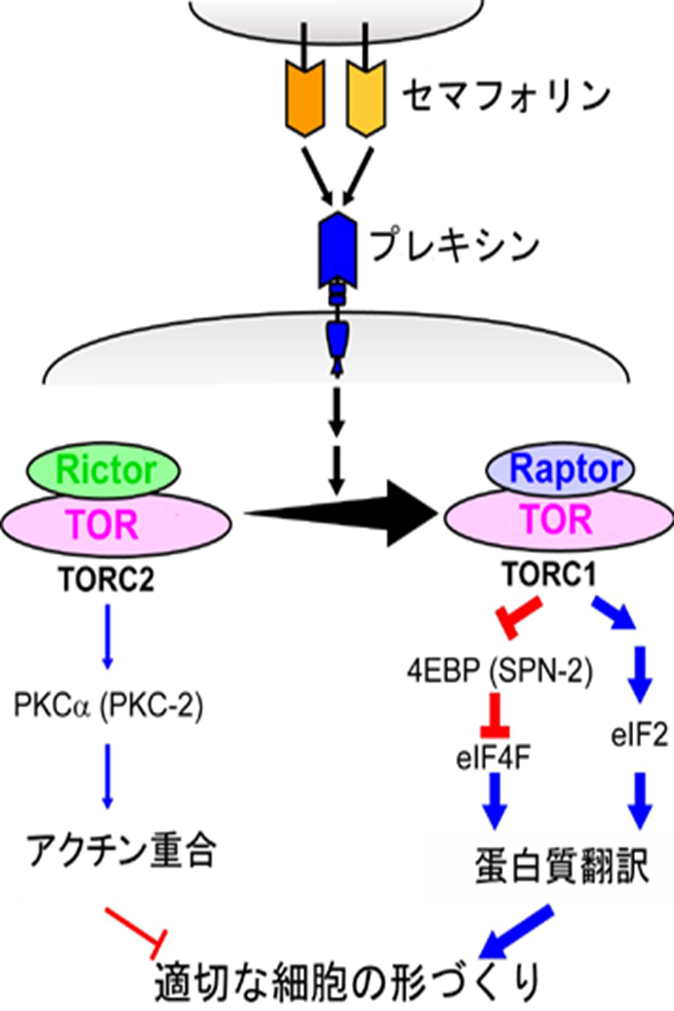
図1.セマフォリンがTOR複合体を通じて
細胞形成を行うメカニズム
セマフォリンは、脊椎動物の脳をはじめとする神経系が形作られる際に伸長する神経線維の行き先を決めるシグナル分子(細胞間での信号をやり取りし、細胞の活動を制御する分子)として有名であり、神経線維再生の研究でも注目されている。 また、ガンの転移抑制や免疫系の活性化、血管形成などにも関与する。 セマフォリンが細胞に結合した後、細胞内でどんな変化が引き起こされて細胞の形態や運動性が変化するのか、その情報の流れを解明することは、神経再生やガン転移等のメカニズムを明らかにすることにつながり、ひいては、神経損傷後の再生やガン治療のための創薬など医療への応用を行う観点から極めて重要となる。
一方、TORと呼ばれる酵素は細胞内において細胞の成長、増殖、移動などを制御することが知られており、ガンや免疫研究でも注目されている。TORは他のタンパク質と組合わさってできるTOR複合体としてはじめて機能するが、これまで、TOR複合体形成の調節機構は良くわかっていなかった。
名古屋大学大学院理学研究科(GCOE理学(生命))の高木 新 准教授らの研究グループは、セマフォリンが、二種類のTOR複合体形成の切り替えを通じて、細胞内のタンパク質の翻訳や細胞骨格を調節することを明らかにした。 同研究グループは非常に効率の良い実験が可能であるモデル動物である線虫C. elegans(Caenorhabditis elegans シェノラブダイティス エレガンス)の遺伝子を操作し、セマフォリンが細胞内で欠損するような遺伝子変異体においてどのような異常が生ずるかを明らかにしている。今回はこのセマフォリン変異体の異常を抑える第2の変異(サプレッサー変異)を検索する手法(サプレッサー変異検索)を利用して、セマフォリンからの情報を伝える細胞内経路を探った。 具体的には、まず、サプレッサー変異を起こした遺伝子部位を特定し、それがTOR複合体TORC2を構成するRictorタンパク質を作る遺伝子の変異であることを突き止めた。このことは、TORC2とセマフォリンが関係していることを示している。そこで、セマフォリンとTOR複合体の関係をさらに調査するため、TORとRaptorタンパク質とによって構成されるもうひとつのTOR複合体TORC1についても分析した。 その結果、TORC1(TORとRaptorの複合体)、TORC2(TORとRictorの複合体)という2種類のTOR複合体中、セマフォリンが前者を増加させ、逆に後者を減少させることを明らかにした。そして、これにともなうTORC1活性の上昇が、eIF2とeIF4Fと呼ばれる二つの因子を通してmRNAからのタンパク質翻訳を上昇させること、一方、TORC2の活性低下が、PKCと呼ばれる酵素の抑制を通じてアクチンの脱重合を促進することを明らかにし、このいずれもがセマフォリンが引き起こす細胞の形態変化に必要であることを見出した(図1)。細胞骨格を構成するアクチンの脱重合化は、細胞の骨格が不安定化して細胞の形が変わりやすくなることを意味する。また、ここでタンパク質翻訳とは、細胞内で細胞を形成するための材料となるタンパク質を作り出すための命令書に相当するmRNAの内容を読み取ることに相当するが、以前に同研究グループはセマフォリンによってアクチン脱重合因子の翻訳が選択的に上昇することを報告している。
セマフォリンが2つのTOR複合体を通じて細胞の形を変化させるという今回の研究結果によって、セマフォリンとTORの関係の詳細が明らかになった。TOR複合体の形成機構についてはこれまでほとんど研究報告がなく、セマフォリンのようなシグナル分子の作用によってTORC1, TORC2の量が同時に調節されることが生体内で証明されたのは初めてである。これらの知見は、セマフォリンという単一のシグナル分子が、様々な細胞内の現象の調節に関与しているTORと深く関わり、ひいては多様な細胞特性に変化を引き起す可能性を示唆しており、今後のセマフォリンおよびTOR研究に重要な指針を与えるものである。
高木 新 准教授は、「今回、セマフォリンとTORの関係を明らかにし、また、特に細胞骨格の変化に関するメカニズムを解明することができた。しかし、TORは細胞骨格制御のみならず細胞の老化やガン化などにも寄与しているとされる。今後は、セマフォリンとTORによる細胞骨格以外の細胞機能の制御についても詳細なメカニズムを解明すべく研究を進めていきたい。さらに、将来的には,こうした研究が創薬などへの応用につながっていくことを期待している。」と話している。
研究者所属
名古屋大学理学部、および、同大学GCOEプログラム "Advanced Systems-Biology: Designing The Biological Function"
参考文献
- Nukazuka A, Tamaki S, Matsumoto K, Oda Y, Fujisawa H and Takagi S. A shift of the TOR adaptor from Rictor towards Raptor by semaphorin in C.elegans. Nature Communications. (2011 Sep 27.) Volume:2, Article number:484 DOI:doi:10.1038/ncomms 1495.

