デバイスに技あり、「瞬時」遺伝子診断が可能に
- Read in English
- ツイート
- 2015/01/27
- 工学研究科
- 安井隆雄助教
- 馬場嘉信教授
名古屋大学大学院工学研究科 化学・生物工学専攻 馬場嘉信教授と安井隆雄助教の研究グループは、大阪大学産業科学研究所 川合知二教授のグループと、世界で初めて、新しいナノスケールのクリスマスツリー構造を利用することによってDNAを数秒解析し、瞬時に遺伝子診断することを可能としました。
今回の研究成果は、2014年6月11日発行の英国『Scientific reports』誌(電子版)に掲載されました。→ 名古屋大学プレスリリース
自己への探求は、今や遺伝子レベル。 それを可能にしたのは、ナノテクノロジーだ。
―体質、性格、顔つき、そして病気まで。
親から子へと伝わる、いわゆる「遺伝」という言葉にも表れるように、人間の身体は遺伝子の指令に基づいて維持されている。
2003年にヒトゲノムの解読完了が達成されて以来、個々人の特性に合わせた最適医療、つまり「オーダーメイド医療」の時代に突入した。中でも中心となっている「遺伝子診断」により、遺伝子に関わる様々な病気においてその遺伝子を特定したり、薬を投与する前に効果や副作用を調べたり、と個人レベルで医療を受けられるようになりつつある。
しかしながら、現在のDNA解析技術にかかる時間は、数十時間程度(「数十時間」が速いのか遅いのかは、これから紹介する内容をご覧いただきたい)。これは、私たちの身体が様々な大きさのDNAで設計されているため、調べたいDNAの大きさに適した分離素材を多数種類用いなければならないのが要因のようだ。
名古屋大学大学院工学研究科の馬場嘉信教授ら研究グループは、そんな遺伝子診断のスピードを驚くほど速くする技術に取り組んできた。今でこそ、その分野は、バイオとナノテクノロジーの融合による「ナノバイオデバイス」分野として通ずるかもしれないが、馬場教授が取り組み出したころは、「ナノテクノロジー」という言葉がまだ無かった80年代末である。
「安・速・短」を求め続けるナノバイオデバイス研究の歴史、ついに馬場教授ら研究グループが世界最速の座に名乗り出た。
*******
1977年、サンガーによりDNA配列を解読する方法が開発され(サンガー法)、その後、ゲルを使った装置(PCR法)が開発されたが、当時の技術では、一人分のDNAを読むのに100年~300年もかかるとされていた。
そこで、世界で協力して始まった「ヒトゲノム解読計画」。1996年に初めて「キャピラリーアレイ シークエンサー」が装置化されて、2003年、ついに一人目のヒトゲノム完全解読が達成された。一人分のDNAを読むのに13年、と大幅に期間短縮できたのである。これは、「装置を300台使うならば、一人分が3か月で読める」という速さになる。
「今後30年間で1億倍の性能向上を達成する必要がある(※2001年ごろ)」
当時2001年ごろ、馬場教授は、既に次のステップに目を向けていた。地球上に70億人いるとして、個々人のゲノムを読むのに「300台で3か月」では遅すぎる。また一人のヒトゲノム解読には、金額にして10億ドルも掛かっていた。
ナノテクノロジーを導入していくことの重要性を訴えながら、先導を切って取り組み出した馬場教授。「1億倍だなんて無茶苦茶な・・」という否定的な意見もある中、抜本的なイノベーション(革新)を実現させるためには「グランドチャレンジ」が必要であるとし、大阪大学の川合教授と共にプロジェクトを立ち上げた(NEDO先進ナノバイオデバイスプロジェクト)。
「今までどれくらい進歩を遂げてきたのか、何を利用するべきかも分かってきたのだから、」
自信があった、と馬場教授は語る。小さい目標からは、小さい技術革新。本当に大きなチャレンジを目指すなら、今あるもの、今やっていることの延長線で研究テーマを選んでいてはいけない。
通常、プロジェクトは数年で成果を出すことが求められる。だからこそ、研究者として先を見越してバックキャスト的に計画を立て、具体的な対策を練らなくてはいけない。新しい開発技術競争のフィールドは世界なのだ。
『1分子DNAもナノサイズ』
※1ナノメートル (nm) = 10-6ミリメートル (mm)、つまり、1ナノは1ミリの百万分の1。
2007年には、馬場教授は川合教授と共同で、内閣府最先端研究開発支援プログラム(FIRST)に採択され、研究課題「1分子解析技術を基盤とした革新ナノバイオデバイスの開発研究」を開始(名古屋大学 革新ナノバイオデバイス研究センター)。
研究は一気に加速したが、世界が注目する研究だけにライバルも多い。実に2007年以降、ゲノム解読速度は、うなぎ上り的にスピードアップを見せ(図1)、それに掛かるコストも2001年では約10億ドルだったのが、今では1,000ドルで読める程にもなったのである(図2)。
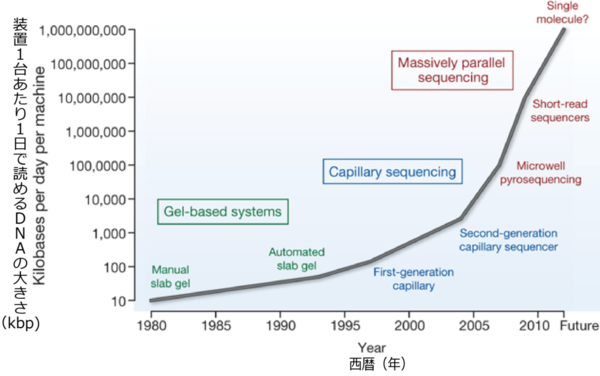 図1. 過去30年からのDNA解読スピードと未来予測(図:MR Stratton et al. Nature (2009) 458: 719-24 Copyright © 2009, Rights Managed by Nature Publishing Group)
図1. 過去30年からのDNA解読スピードと未来予測(図:MR Stratton et al. Nature (2009) 458: 719-24 Copyright © 2009, Rights Managed by Nature Publishing Group)
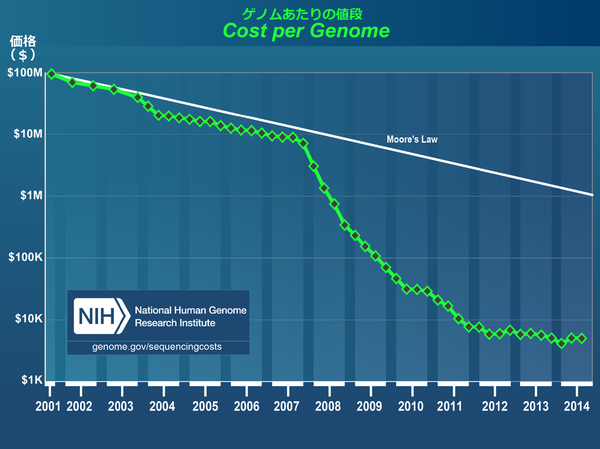 図2. ゲノムあたりの価格(図:NHGRI Genome Sequencing Program (GSP)より抜粋)
図2. ゲノムあたりの価格(図:NHGRI Genome Sequencing Program (GSP)より抜粋)
そんな勢いある世界のフィールドへ大きく貢献した技術の一つが、ナノポア技術(NIH(アメリカ国立衛生研究所)発表)。大阪大学の川合研究室で開発されてきたナノポア技術にも更なる期待が集まっている(Kawai, et al. Nature Nanotechnology (2010) 5: 286-90)。
ナノポアとは、DNA分子と同じくらいの大きさの孔(直径約2ナノメートル)で、この孔に、ひも状に長く伸ばした1本のDNAを通過させる。孔には電極が作り込まれているため、DNAの塩基の種類により電導度に違いが見出され、従って、塩基配列が読めるのだ。その速さ、1塩基対(1bp)= 1ミリ秒。ヒトゲノムサイズは約31億bpだが、並列解読も可能なため、1日程度で全ゲノムが解読可能だという。
しかし、問題点もあった。ポア(孔)のサイズがバラバラであることから、例えば患者さんから血液を採取した後、手作業で前処理しなければならなかった。その作業にマンパワーや時間を要するため、分離操作の重要性が持ち上がることになる。
分離技術としては、馬場教授ら研究グループの加地範匡准教授が、大きさを揃えたナノサイズの柱を並べたナノピラー構造体(図3)の開発に携わっていた。2004年には、6種類の異なる大きさのDNAをわずか680秒で分離することに成功し、当時、世界最速の分離技術であった(Kaji, et.al. Anal. Chem. (2004) 76: 15-22)。ナノピラー構造体はジグザグ構造をしており、そこの合間をぬってDNAは流れていく。
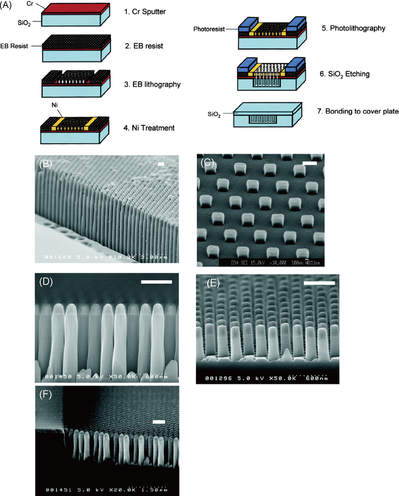
図3. (A)ナノピラー構造体の作製工程 と(B~F)ナノピラー構造体のSEM画像。スケールバーは、500 nmを示す(図は Anal. Chem. (2004) 76: 15-22. Copyright (2004) American Chemical Society)
その後、当時(2006年)、大学4年生だった同研究グループの安井隆雄助教は、ナノピラーのジグザグ構造ではなく、真っ直ぐに配列する構造の場合をテーマに、分離原理の研究を進めていた。ジグザグ構造だと、大きいDNAは引っかかる為小さいDNAから流れてくるが、真っ直ぐに配列させると大きなDNAから流れてくる。
「何にしても、天然構造物であるゲルの様な3次元構造体には敵わない。」
ナノピラーは2次元のナノ構造体。それでは分離技術にも限界がある、と感じていた安井助教。3次元構造体が作れないものかと悩んでいた矢先、川合教授との共同研究から、大阪大学 産業科学研究所の柳田剛准教授(現在、九州大学先導物質化学研究所 教授)にナノワイヤー技術を紹介してもらった。
基本的にナノワイヤーは、直径10ナノメートル程度の大きさで、下から上に成長する2次元構造をとる。ナノワイヤーは金を撒いたところからしか生えないことをヒントに、3次元構造にするには、ナノワイヤーの側面からもナノワイヤーを成長させればいいことを思いつく(図4)。
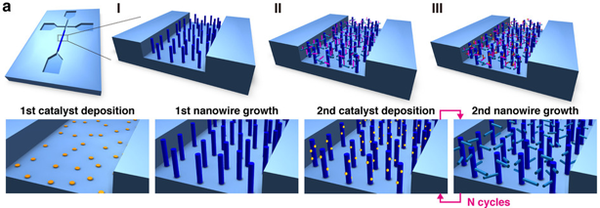 図4. 3Dナノワイヤーの成長工程を示した模式図。I、II、IIIは、それぞれN=1、3、5のとき。(図は、Sakon Rahong et al. Scientific Reports (2014) 4: 5252 Copyright © 2014, Rights Managed by Nature Publishing Group)
図4. 3Dナノワイヤーの成長工程を示した模式図。I、II、IIIは、それぞれN=1、3、5のとき。(図は、Sakon Rahong et al. Scientific Reports (2014) 4: 5252 Copyright © 2014, Rights Managed by Nature Publishing Group)
柳田教授のアドバイスを受け、金の真空蒸着(スパッタリング)装置において真空圧力を悪くした際、金触媒をナノワイヤーの側面に散布することに成功。こうして、金触媒のスパッタリングとナノワイヤーの成長を繰り返しながら、ナノワイヤーの3次元構造を完成させていったのである(図5)。
 図5. 3Dナノワイヤー構造体のSEM画像。スケールバーは、1 μmを示す(※1 μm=1 mmの1000分の1)。I、II、IIIは、図4でのN=1、3、5に相当する。(図は、Sakon Rahong et al. Scientific Reports (2014) 4: 5252 Copyright © 2014, Rights Managed by Nature Publishing Group)
図5. 3Dナノワイヤー構造体のSEM画像。スケールバーは、1 μmを示す(※1 μm=1 mmの1000分の1)。I、II、IIIは、図4でのN=1、3、5に相当する。(図は、Sakon Rahong et al. Scientific Reports (2014) 4: 5252 Copyright © 2014, Rights Managed by Nature Publishing Group)
クリスマスの頃、そのナノワイヤーの3次元構造は完成した。その見た目がモミの木の様であることから、安井助教らは「ナノクリスマスツリー」という通称で呼んでいる。
ナノクリスマスツリーは、DNAがその3次元構造に絡み付くことで、機能を発揮。電場をかけることで、様々な大きさのDNA(100bp~166kbp ※1kbp = 1,000bp)をわずか13秒以内に解析することが可能となった。参考として、2004年のナノピラー構造体の分離速度で6種類の異なる大きさのDNAが用いられたが、ナノクリスマスツリーは、その時と同じ6種類のDNAをわずか12秒で分離することができる。ナノピラー構造体と比べて、約50倍速い分離技術となる。
ここに、DNA解読速度の驚くべき速さをご覧いただこう。注)ストップボタンを押しそびれないように・・。
5-cycle成長工程で作製したナノワイヤー構造体のスピード比較(100bp~166kbpのDNAサイズ)
【電界強度:500V/cm】
(動画は、Sakon Rahong et al. Scientific Reports (2014) 4: 5252 Copyright © 2014, Rights Managed by Nature Publishing Group)
38kbpのDNAサイズに対してのスピード比較(ゲル【電界強度:300V/cm】と5-cycle成長工程で作製したナノワイヤー構造体【電界強度:50V/cm】)
(動画は、Sakon Rahong et al. Scientific Reports (2014) 4: 5252 Copyright © 2014, Rights Managed by Nature Publishing Group)
*******
2013年5月に発表された、マッキンゼー・アンド・カンパニーの「破壊的技術」の一つに「安・速・短」遺伝子解析技術を含んだ「ゲノムに関する次世代科学」が選ばれた。2025年、7,000億ドルから1兆6,000億ドルの市場が期待できると予測(McKinsey&Company May 2013)。
「破壊的技術」とは、既存市場では必要な性能を持たないために受け入れられないが、新しい顧客に対して新しい価値をもたらす新製品を生み出すような技術のこと。(出典: 情報マネジメント用語辞典 )
真のイノベーションには、ガイドラインを変える程の新たな価値が必要となる
― エンジニアは世界を変えることができる。
(梅村綾子)
研究者紹介
馬場 嘉信(ばば よしのぶ)氏【名古屋大学大学院 工学研究科 教授】
 1981年九州大学理学部化学科卒業。1986年同大学院理学研究科化学専攻博士課程修了、1986年大分大学助手・講師、1990年神戸薬科大学講師・ 助教授、1997年徳島大学教授を経て、2004年より名古屋大学・工学研究科教授。同大学革新ナノバイオデバイス研究センター長、同大学シンクロトロン光研究センター長、同大学未来社会創造機構教授、同大学医学系研究科協力講座教授、産業技術総合研究所健康工学研究部門研究 顧問を併任。専門は分析化学、ナノバイオサイエンス。
1981年九州大学理学部化学科卒業。1986年同大学院理学研究科化学専攻博士課程修了、1986年大分大学助手・講師、1990年神戸薬科大学講師・ 助教授、1997年徳島大学教授を経て、2004年より名古屋大学・工学研究科教授。同大学革新ナノバイオデバイス研究センター長、同大学シンクロトロン光研究センター長、同大学未来社会創造機構教授、同大学医学系研究科協力講座教授、産業技術総合研究所健康工学研究部門研究 顧問を併任。専門は分析化学、ナノバイオサイエンス。
Merck Award(2004);
日本化学会学術賞(2008)、他。
***
産学官連携でご研究を勢いよく進める馬場氏。取材時、「イノベーションの起こし方」の講義を受けているようで、ワクワクが止まらなかった。
2025年は、どんな世界になっているのだろうか? 私たちの社会、そして生活そのものを変えるイノベーション。馬場研究室のご活躍に期待したい(梅)
安井 隆雄(やすい たかお)氏【名古屋大学大学院 工学研究科 助教】
 2007年名古屋大学工学部化学・生物工学科卒業。2009年同大学院工学研究科化学・生物工学専攻博士課程前期課程修了、2009年日本学術振興会特別研究員(DC1)として、名古屋大学大学院工学研究科化学・生物工学専攻博士課程後期課程で研究に従事し、2011年早期修了、名古屋大学より工学博士の学位取得。2011年日本学術振興会特別研究員(PD)を経て、2012年より現職。2014年より、革新的研究開発推進プログラム(ImPACT)PM補佐を併任。専門は分析化学、ナノ材料・ナノ空間科学。
2007年名古屋大学工学部化学・生物工学科卒業。2009年同大学院工学研究科化学・生物工学専攻博士課程前期課程修了、2009年日本学術振興会特別研究員(DC1)として、名古屋大学大学院工学研究科化学・生物工学専攻博士課程後期課程で研究に従事し、2011年早期修了、名古屋大学より工学博士の学位取得。2011年日本学術振興会特別研究員(PD)を経て、2012年より現職。2014年より、革新的研究開発推進プログラム(ImPACT)PM補佐を併任。専門は分析化学、ナノ材料・ナノ空間科学。
第6回わかしゃち奨励賞優秀賞(2012);
第29回井上研究奨励賞(2013);
化学とマイクロ・ナノシステム学会若手優秀賞(2014)、他。
***
安井氏への取材の日、名古屋の街は珍しく雪が積もり一面真っ白となった(注:名古屋人は雪道に慣れていない)。取材後、安井氏は東京へ出張というご多忙ぶりにも関わらず、とても気さくに研究室を案内してくれた。・・そこで待ち構えていたのは、ドッキリ、面白かった(写真右:等身大のペーパークラフトです)。
安井氏の見せる余裕さの奥には、イノベーションを見据えた力強さがある。今後益々のご活躍を応援していきたい(梅)
情報リンク集
- 名古屋大学 革新ナノバイオデバイス研究センターHP http://www.nanobio.nagoya-u.ac.jp//index.html
- 馬場研究室HP https://www.chembio.nagoya-u.ac.jp/labhp/bioanal1/
- 独立行政法人新エネルギー・産業技術総合開発機構(NEDO)先進ナノバイオデバイスプロジェクト http://www.nedo.go.jp/activities/ZZ_00285.html
- 内閣府最先端研究開発支援プログラム(FIRST) http://www.jsps.go.jp/j-first/index.html
- アメリカ国立衛生研究所(NIH) http://www.nih.gov/
- 今回の論文のリンク先(検索結果から)
http://www.sciencedirect.com/science/article/pii/S2211124714008602
Sakon Rahong, Takao Yasui, Takeshi Yanagida, Kazuki Nagashima, Masaki Kanai, Annop Klamchuen, Gang Meng, Yong He, Fuwei Zhuge, Noritada Kaji, Tomoji Kawai & Yoshinobu Baba
Ultrafast and Wide Range Analysis of DNA Molecules Using Rigid Network Structure of Solid Nanowires.
Scientific Reports 4: 5252 (2014).
(First published on June 11, 2014; doi:10.1038/srep05252)
- その他論文のリンク先(検索結果から)
http://www.nature.com/nnano/journal/v5/n4/full/nnano.2010.42.html
Makusu Tsutsui, Masateru Taniguchi, Kazumichi Yokota & Tomoji Kawai
Identifying single nucleotides by tunnelling current.
Nature Nanotechnology 5: 286 (2010).
(First published on March 21, 2010; doi: 10.1038/nnano.2010.42)
- その他論文のリンク先(検索結果から)
http://pubs.acs.org/doi/abs/10.1021/ac030303m
Noritada Kaji, Yojiro Tezuka, Yuzuru Takamura, Masanori Ueda, Takahiro Nishimoto, Hiroaki Nakanishi, Yasuhiro Horiike, and Yoshinobu Baba
Separation of Long DNA Molecules by Quartz Nanopillar Chips under a Direct Current Electric Field.
Anal. Chem. 76: 15 (2004).
(First published on November 26, 2003; doi:10.1021/ac030303m)

