複雑化する医農薬品などの開発・製造に新合成法を提案
- Read in English
- ツイート
- 2016/03/18
- 工学研究科
- 波多野学准教授
- 石原一彰教授
名古屋大学大学院工学研究科の石原一彰教授、波多野学准教授、山川勝也さん(博士後期課程1年生)らの研究チームは、新医農薬品などの開発・製造に必要不可欠となる化合物「光学活性α-シアノヒドリン」の効率的な合成法の開発に成功しました。
反応実施例25例の全てにおいて2~9時間(最短記録)で完結し、スケールアップの容易さも実証できたことから、工業スケールへの適用も見込みが高い堅牢な合成技術と言えます。これにより、これまで入手困難であった市場ニーズの高い光学活性化合物を選択的に製造することが可能となり、新医農薬品の開発・製造の一助になることが期待されます。
本研究成果は、「Angewandte Chemie International Edition」のオンライン版に2016年2月2日に掲載され(Angew. Chem. Int. Ed. 2016, 55(12), 4021-4025, DOI: 10.1002/anie.201510682)、本誌のCover Pictureに採用される栄誉を受けました。→ 名古屋大学プレスリリース
匠の業が光るシンプルかつグリーンな新合成法。スケールアップしても、短時間で高選択的かつ高収率な結果に、産学連携への展開も期待する。
「研究開発は、より高度化、複雑化、そして大規模化しています。」
名古屋大学大学院工学研究科の石原一彰教授および波多野学准教授ら研究グループは、開発の複雑化が進んでいると言われる医農薬品など新規化合物の製造に向け、より効率的な合成法を提案する。さらに目指すは、環境保全を意識した合成法。害あるものを出さないこと、それを可能とする触媒を開発しているのだ。
触媒の重要性・将来性は、2001年に名古屋大学の野依良治教授が、触媒的不斉合成をテーマにノーベル化学賞を受賞したことからも伺い知れる。ごく少量の触媒を用いて無限大にも様々な化合物を合成できるので、実用的な合成手段として活発に研究されている分野だ。
今回、研究グループは、新規に触媒を開発し、医農薬品などの開発・製造に必要不可欠となる光学活性α-シアノヒドリンの新しい合成法を提案することに成功した。本合成技術を利用することで、これまで入手困難であった市場ニーズの高い光学活性化合物を選択的に製造することも可能となり、光学活性原料・中間体の拡充へと発展していくだろう、と期待を込める。
*******
—化学反応を自在に操るために
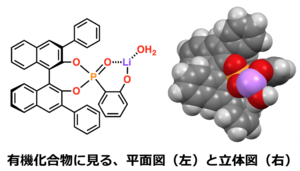
「通常、有機化合物は、複雑な3次元構造をとっています。」
有機化合物は、紙面に見る平面的な構造ではなく、立体構造を持っている。つまり、平面的に書く構造式は同一でも、原子の空間的配列が異なると「同じもの」ではなく、立体異性体として区別される。そもそも、空間的配列が異なると、性質そのものが異なることが多い。
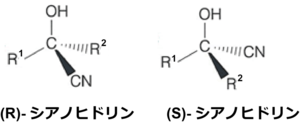
例えば、左手と右手の関係にある鏡像異性体(エナンチオマー)を持つサリドマイドは、片方は薬となるが、もう片方は毒になることで知られている(図1)。このように、光学活性(キラル)な物質は、化合物としての有用性を見極め、合成産物を確実に分別するか、そもそも選択的に合成していく必要がある。
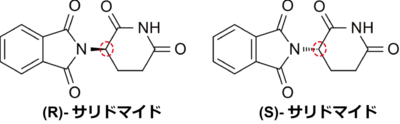 図1. 鏡像異性体を持つサリドマイド。R体は薬としての効果があるが、S体は毒となる。キラル中心または不斉中心(赤丸)のため、左手と右手でそれぞれ手の甲と手の平が上に向く構造をとる。
図1. 鏡像異性体を持つサリドマイド。R体は薬としての効果があるが、S体は毒となる。キラル中心または不斉中心(赤丸)のため、左手と右手でそれぞれ手の甲と手の平が上に向く構造をとる。
石原教授らは、本研究において、医農薬品などの開発・製造に必要不可欠となる光学活性α-シアノヒドリンを挙げ、高選択的に合成するための触媒開発に努めた。不斉触媒技術として方法論を確立すれば、不斉炭素を有する光学活性α-シアノヒドリンは、その多様な立体構造から商品価値の高い多品目の光学活性化合物を製造できるようになる。また、医農薬品を設計する際のパーツとなり得る合成素子を集めて「キラル合成素子ライブラリー」を構築し活用すれば、新医農薬品の開発や不斉触媒の更なる開発・製造の一助となることが期待される。
—世の中に「まだない」パーツを作り出す
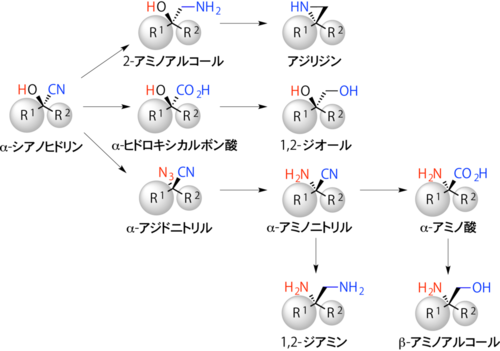
α-シアノヒドリンは、同一炭素原子に化学変換可能な官能基、ヒドロキシ基(-OH)とシアノ基(-CN)が結合した化合物の総称である。例えば、光学活性α-シアノヒドリンは、医薬品中に広く用いられている重要な化合物であるα-ヒドロキシカルボン酸、α-アミノ酸、β-アミノアルコールなどの有用な光学活性化合物に化学変換できるのだ(図2)。
図2. 光学活性α-シアノヒドリンとその誘導体
これまで、アルデヒド由来の光学活性α-シアノヒドリンについては、優れた合成法が多数報告されており、既に工業スケールでも製造されてきた。しかし、更に複雑な構造多様性を達成するには、アルデヒド由来だけではなく、ケトン由来の光学活性α-シアノヒドリンを合成することが必要となる(図3)。
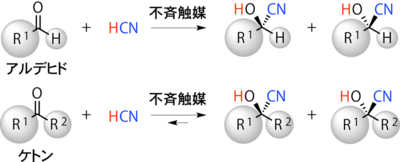 図3. アルデヒド由来とケトン由来での、シアノヒドリン合成。ケトン由来は、置換基R1とR2を持ち、アルデヒド由来に比べて更に複雑な構造多様性を達成できる。ここでカギとなるのは、「不斉触媒」のデザイン設計。
図3. アルデヒド由来とケトン由来での、シアノヒドリン合成。ケトン由来は、置換基R1とR2を持ち、アルデヒド由来に比べて更に複雑な構造多様性を達成できる。ここでカギとなるのは、「不斉触媒」のデザイン設計。
ここに多くの合成化学者らが挑戦する困難な壁があった。
ケトンはアルデヒドに比べて反応性が低い。不斉誘導も難しい上に、生成物も分解しやすいためスケールアップが難しい、など反応条件の許容範囲の狭さを克服しなければならない。
「そこで、触媒のデザインが選択的反応を制御するカギとなるのです。」
より優れた不斉触媒が開発されていく中で、未知の可能性を秘めた「まだない」パーツは作り出されていく、と石原教授は説明する。
—シンプルな触媒設計だからこそ、オリジナリティにこだわる
「触媒のデザインは、ここ十数年掛けて進化させていきました。」
波多野准教授は、石原研究室の立ち上がり当初より、学生を指導しながら本課題に取り組んできた。学生とともに成長を重ね、触媒としても今回で三代目となる。
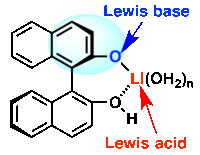 図4. 一代目の触媒。リチウムカチオンがルイス酸としてアルデヒドを活性し、同時に触媒のフェノキシアニオンがルイス塩基としてシアノ化剤を活性する。
図4. 一代目の触媒。リチウムカチオンがルイス酸としてアルデヒドを活性し、同時に触媒のフェノキシアニオンがルイス塩基としてシアノ化剤を活性する。
一代目の触媒(図4)は、アルデヒド由来の光学活性α-シアノヒドリン合成を目的に開発した。(Hatano et al. J. Am. Chem. Soc. 2005, 127, 10776)
触媒の製造過程は煩雑であることが多い。一方、波多野准教授らは、両エナンチオマーが市販されているBINOL(1,1’-ビナフトール)にリチウム源と水を入れただけ、という非常にシンプルな製造過程を提案し、世界中の研究者らに驚きを与えた(当時、JACSアクセスランキング第1位)。
「興味深かったのは、当時学部4年生の池野さんがやると上手くいくのに、私がやると上手くいかなかったのです。」
波多野准教授は、本実験操作の面で重要なことに気付いたという。
触媒の製造過程においては、通常、湿気が入らないように容器の乾燥というものをする。当時は特に梅雨の時期—波多野准教授は容器の乾燥を確実に施した。空気中の水分の「遮断があまい」と、微量の水が混入することになるからだ。
しかし、本触媒製造過程においては、微量の水が必要だった。波多野准教授と池野さんの共同作業により、水が全く混入しない場合(不斉収率58%)と微量の水が含まれる場合(不斉収率95%)の2通りを示すことで、科学的な気付きをも得られたのである。
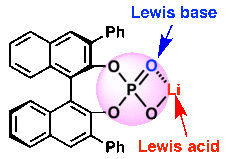 図5. 二代目の触媒。リン酸触媒にフェノール(Phで表示)とリチウムを追加した。
図5. 二代目の触媒。リン酸触媒にフェノール(Phで表示)とリチウムを追加した。
二代目(図5)は、ケトン由来の光学活性α-シアノヒドリン合成を目的に取り掛かった。(Hatano, et al. Adv. Synth. Catal. 2008, 350, 1776)
波多野准教授らはBINOL骨格を有するリン酸触媒を用いることにした。リン酸触媒にも、両エナンチオマーが存在する。また実施しやすい反応速度で、高い選択性を示す、という利点があることから、現在では不斉触媒として数多くの有用な変換反応に利用されている。
リン酸触媒をこのまま用いても上手くいかなかったのだが、波多野准教授らは一代目の触媒の構造をヒントに、このリン酸触媒にリチウムを入れてみた。
通常、触媒の酸や塩基は非常に弱いが、触媒内に酸点と塩基点が共存すれば、二重活性により反応を相乗的に活性できる。今回開発した触媒の場合、触媒のリチウムカチオンが酸としてケトンを活性し、同時に触媒のフェノキシアニオンが塩基としてシアノ化剤を活性する。
そして期待通りにも、見事にケトン由来の光学活性α-シアノヒドリンが合成できた。ただし、非常に限定的で1~2種類のケトンでしか上手くいかず、不斉収率も80%台、と高いとは言えなかった。
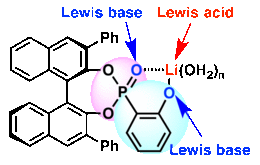 図6. 三代目の触媒。二代目の触媒に更にフェノールを足し、シアノ化剤の高活性化に対応。
図6. 三代目の触媒。二代目の触媒に更にフェノールを足し、シアノ化剤の高活性化に対応。
「触媒活性を更に上げることが必要なのですが、そのためにはフェノールをどこに足すか、が問題でした。」
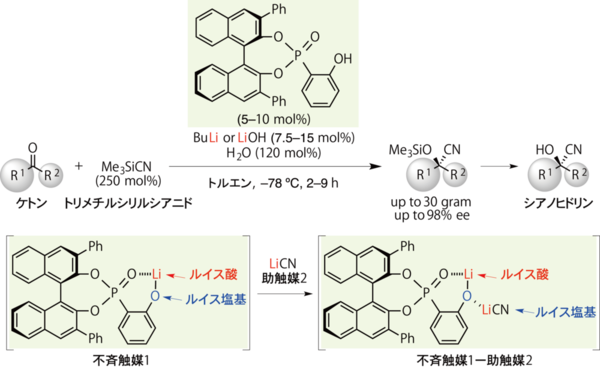
波多野准教授は、触媒活性を上げるにはフェノールが必要だということを明らかにし、二代目の触媒にフェノールを足すことで、今回、三代目(図6)となる2-ホスホリルフェノールのリチウム塩触媒をデザインした。
シアノ化剤の高活性化も工夫した。
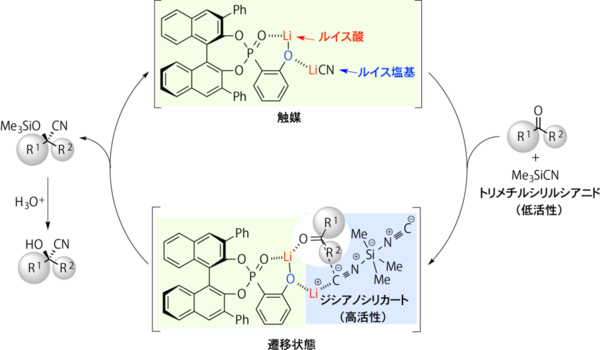
当初、シアノ化剤として用いたシアン化トリメチルシリルは安全に扱うことができる試薬であるものの、波多野准教授らは、活性としては不十分であると判断した。そこで、活性が高いことで知られるシアノ化剤(リチウムジシアノシリカート<LiMe3Si(CN)2>)を用いることにした。通常、リチウムジシアノシリカート<LiMe3Si(CN)2>は、活性が高すぎるため不斉触媒による立体化学制御には不向きと考えられてきたが、今回の反応性の低いケトンを基質に用いる場合、有効に働くと予測したのである。
波多野准教授らは、まず、適量の水と触媒量のブチルリチウムを反応させ、助触媒シアン化リチウムを発生させた。そして、この助触媒シアン化リチウムとシアン化トリメチルシリルを反応させることで、高活性シアノ化剤を合成した(図7)。
図7. 適量の水と触媒量のブチルリチウムを反応(不斉触媒1)させた後、シアン化リチウム(助触媒2)を発生させることで、不斉触媒1―助触媒2の、更に強力な触媒が完成。
「このシアノヒドリンの合成過程では、助触媒を用いることも大切なのです。」
波多野准教授らの予測通り、ケトンを基質に、高活性シアノ化剤を活用したところ、先に開発した酸塩基複合触媒が有効に働き、結果、短時間で高選択的かつ高収率で、シアノヒドリンのシリルエーテルを合成することに成功したのである(図8)。
「スケールアップしても、短時間で高選択的、かつ高収率な結果が得られました。」
石原教授と波多野准教授は、実用化に向けての第一歩も切り出せた、と話す。より複雑化する研究開発に対し、シンプルかつグリーンな触媒設計で次なる展開「産学連携」にも期待を込める。
*******
「常に記録を更新していくオリンピックのようなものです。」
触媒の開発にゴールというものはない、と石原教授は話す。研究者らは、触媒調整が容易で、安価で、グリーンで、・・・、とハードルを上げていきながら、記録を更新していく。
触媒を知り尽くせば、オリジナリティも出していける、と波多野准教授は話す。害あるものは元々使わなければ問題ないはず、とリチウムを用いた触媒設計にこだわり続けながら、今回のような着実な成果を導けたのだ。
「新」を生み出すモノづくり
—大切なのは、根本的なところを操る知識と溢れるアイデア、そして匠のプライドだ
(梅村綾子)
研究者紹介
石原 一彰(いしはら かずあき)氏【名古屋大学大学院 工学研究科 教授】
 1981年名古屋大学工学部応用化学科を卒業後、同大学工学研究科で1987年修士号、1991年博士号を取得。その後1991年~1992年、米国ハーバード大学にて博士研究員として研究に従事した。1992年~1994年名古屋大学工学研究科応用化学専攻にて助手、1994年~1997年同大学同研究科生物機能工学専攻にて助手を務めた。1997年~2001年名古屋大学難処理人工物研究センターで助教授を務め、グリーンケミストリーを展開した。2002年より名古屋大学大学院工学研究科生物機能工学専攻の教授となり、現在に至る。
1981年名古屋大学工学部応用化学科を卒業後、同大学工学研究科で1987年修士号、1991年博士号を取得。その後1991年~1992年、米国ハーバード大学にて博士研究員として研究に従事した。1992年~1994年名古屋大学工学研究科応用化学専攻にて助手、1994年~1997年同大学同研究科生物機能工学専攻にて助手を務めた。1997年~2001年名古屋大学難処理人工物研究センターで助教授を務め、グリーンケミストリーを展開した。2002年より名古屋大学大学院工学研究科生物機能工学専攻の教授となり、現在に至る。
***
生物機能工学コースで生物有機化学の講義を担当したことをきっかけに、生物の「酵素」を触媒開発の手本にするようになったという石原氏。「酵素は無駄を出さない。副産物を出したとしても、それを処理するのも酵素であるところに自然の仕組み、成り立ちを学ぶ」として、触媒開発も「酵素」のようにグリーンであることを目指し、こだわりの分子修飾を手掛けている。
まさに「分子世界の匠(2015年度オープンレクチャー・タイトルより引用)」を率いるリーダー、石原氏。今後のご活躍も益々期待したい(梅)
波多野 学(はたの まなぶ)氏【名古屋大学大学院 工学研究科 准教授】
 1998年東京工業大学工学部化学工学科卒業後、2000年同大学大学院理工学研究科で修士号取得。2000年4月~2003年3月まで日本学術振興会特別研究員として、東京工業大学大学院理工学研究科博士後期課程で研究に従事し、2003年に博士号取得。その後、名古屋大学大学院工学研究科にて、2003年に助手、2007年より講師、そして2012年より准教授となり、現在に至る。
1998年東京工業大学工学部化学工学科卒業後、2000年同大学大学院理工学研究科で修士号取得。2000年4月~2003年3月まで日本学術振興会特別研究員として、東京工業大学大学院理工学研究科博士後期課程で研究に従事し、2003年に博士号取得。その後、名古屋大学大学院工学研究科にて、2003年に助手、2007年より講師、そして2012年より准教授となり、現在に至る。
(写真:波多野准教授(右)と山川さん(左))
***
研究室内にデスクを構え、研究に勤しむ学生らの質問にも常に答えられるようにしている、という波多野氏。歴代の触媒開発は、学生らとディスカッションを通しながらの卒業研究でもあった。未知の領域に挑む学生にとって、波多野氏からの指導は心強いサポートにちがいないだろう。
波多野氏らのシンプルな触媒設計は、製造しやすいという良さの反面、コピーされやすい、という危険も多いという。「だからこそオリジナリティを追求する」という匠のプライドを感じられた。今後のご研究成果も楽しみだ(梅)
情報リンク集
- 名古屋大学大学院 工学研究科 石原研究室 HP http://www.ishihara-lab.net/
- 名古屋大学大学院 工学研究科 HP http://www.engg.nagoya-u.ac.jp/
- 名古屋大学大学院 工学研究科 石原研究室 Facebook Page https://www.facebook.com/kishiharalab/
- 名古屋大学大学院 工学研究科 石原研究室 Twitter https://twitter.com/PIodide
- 今回の論文のリンク先(検索結果から)
(カバーレター)http://onlinelibrary.wiley.com/doi/10.1002/anie.201601600/abstract
(論文)http://onlinelibrary.wiley.com/doi/10.1002/anie.201510682/abstract
Manabu Hatano , Katsuya Yamakawa, Tomoaki Kawai, Takahiro Horibe, and Kazuaki Ishihara.
Enantioselective Cyanosilylation of Ketones with Lithium(I) Dicyanotrimethylsilicate(IV) Catalyzed by a Chiral Lithium(I) Phosphoryl Phenoxide.
Angew. Chem. Int. Ed. 55, 4021-4025 (2016).
(First published on February 24, 2016; doi: 10.1002/anie.201601600)
- その他論文のリンク先(検索結果から)
http://pubs.acs.org/doi/abs/10.1021/ja051125c
Manabu Hatano , Takumi Ikeno , Takashi Miyamoto , and Kazuaki Ishihara.
Chiral Lithium Binaphtholate Aqua Complex as a Highly Effective Asymmetric Catalyst for Cyanohydrin Synthesis
J. Am. Chem. Soc. 127: 10776 (2005).
(First published on July 13, 2005; doi: 10.1021/ja051125c)
- その他論文のリンク先(検索結果から)
http://onlinelibrary.wiley.com/doi/10.1002/adsc.200800314/abstract
Manabu Hatano, Takumi Ikeno, Tokihiko Matsumura, Shinobu Torii, and Kazuaki Ishihara.