NEDO Technology Commercialization Program 最優秀賞受賞 多田安臣教授&野元美佳さん 特別インタビュー
- ツイート
- 2016/04/26
- A Protein Synthesis System 3.0チーム
- 多田安臣教授 (遺伝子実験施設)
- 野元美佳さん (理学研究科 大学院生)
名古屋大学 遺伝子実験施設の多田安臣教授と理学研究科の野元美佳さん(大学院生)は、学術研究・産学官連携推進本部の南賢尚特任講師と福田雄一特任講師と「A Protein Synthesis System 3.0チーム」を結成し、2015年12月9日に行われた国内の大学発起業家支援プログラムNEDO Technology Commercialization Program(TCP)2015において最優秀賞を受賞しました。昨年度の西谷智博特任講師・鈴木孝征助教のチーム「Photocathode Electron Soul」に続く二年連続の快挙です。
参照: Photocathode Electron Soulチーム 西谷智博特任講師の特集記事
「A Protein Synthesis System 3.0」チームは、無細胞・小麦胚芽抽出液系のタンパク質合成キットとタンパク質のカタログ販売を事業とし、遺伝子・タンパク質研究現場に実験対象となるタンパク質を迅速・簡便に届け、実験・研究環境にイノベーションをもたらすことを目指しています。研究段階において、本技術の開発に至った経緯を伺うべく、多田教授および野元さんを取材しました。
(聴き手:梅村綾子/NU Research)
多田教授(左)と 野元さん(右)
「最初は、自分の研究テーマのために作った合成システムだった。」 ――世界中の研究者らの注目を集め、そして今、チーム一丸となってイノベーション創出を目指す。
本技術開発の背景とは
NU Research:
この度はTCP最優秀賞受賞とのこと、おめでとうございます。
是非とも、本技術がどのように開発されていったのか、その研究経緯についてお聞かせください。
はじめに、多田研究室では、何をテーマに研究しているのでしょうか?
多田教授:

この研究室では、植物病理学をテーマに研究しています。植物病理学とは、植物の病気について、その症状や原理を究明し、病害を防ぐ方法や対策などを研究する学問です。
例えば、野元さんの研究テーマに関連して、植物の自然免疫についてお話しましょう。
植物には、植物の自然免疫を司る制御因子の一つで、NPR1という名のタンパク質が存在していることが知られています。NPR1が存在しないと免疫不全の植物となり、色んな病害に対して感受性を示すようになってしまいます。
さて、ここで重要なことですが、基本的に、タンパク質はタンパク質同士の相互作用を介しながら情報を伝える、ということをしています(図1)。実は、NPR1については、NPR1自体は重要な制御因子であることは分かっていたものの、その伝達相手にあるタンパク質についてはほとんど分かっていなかったため、原理的にNPR1が ”何をしているのか” 謎に包まれたままでした。
図1. NPR1は、様々なタンパク質に情報伝達する(※X、Y、Zは、”様々な”タンパク質を表す)
NU Research:
どのような方法で、タンパク質の相互作用を調べるのですか?
多田教授:
従来の一般的な方法としては、酵母ツーハイブリッド法(yeast two-hybrid system)があります。どんな方法かと言うと、まず一つ一つの酵母の中で、それぞれNPR1や他のタンパク質を人工的に発現させます。その人工的に作られたNPR1と他のタンパク質とが相互作用のパートナーであるならば、それらは“生きてくる”、つまりプレート上に撒いたときにも活性を見せるのです。こうしてタンパク質の相互作用を調べています。
しかし、この方法が機能しないことが多々ありました。世界中の研究者が挑戦するも、相互作用因子としてのタンパク質は一つくらいしか見つかっていなかったのです。そもそも、植物と酵母は異なる生物ですから、植物のタンパク質が酵母の中でうまく機能しないこともあるのだと思います。そこで、野元さんの研究では、酵母を用いるのではなく植物そのものを用いることにしました。
NU Research:
植物を用いる方法ならば、タンパク質の相互作用はどう調べることができるのですか?
多田教授:
「無細胞タンパク質合成システム」であれば、チューブの中でRNA転写からタンパク質合成までを行うことができます。このシステムは、Marshall Warren Nirenberg博士によって初めて構築されました(1968年ノーベル生理学・医学賞)。
細胞内にはリボソームというタンパク質合成システムがあり、RNAの遺伝子情報を読み取ってタンパク質を合成する働きをしています(図2)。Nirenberg博士は、リボソームなどのタンパク質合成に必要である細胞装置を含んだ、大腸菌の抽出液に人工RNAを加え、その暗号解読に成功したのです。
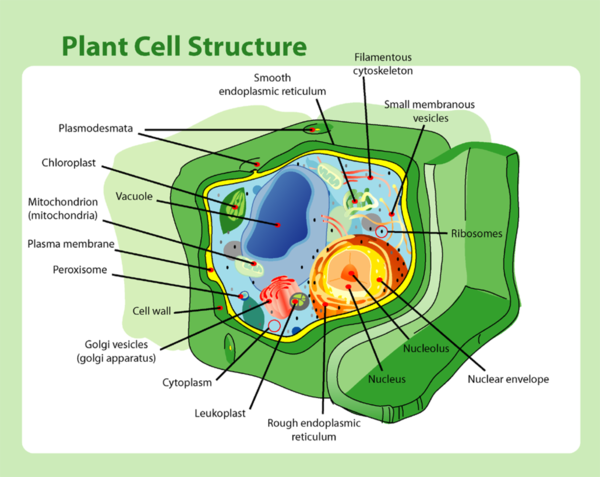 図2. 植物細胞を構成する様々な器官。リボソーム(Ribosomes)はその一つ。
図2. 植物細胞を構成する様々な器官。リボソーム(Ribosomes)はその一つ。
多田教授:
その後、「無細胞タンパク質合成システム」は進化の一途を辿ります。
原核生物である大腸菌の他に、世界中の研究者らは、昆虫細胞、ウサギの網状赤血球、小麦の胚などから得られた抽出液にRNAを加えることで、タンパク質を合成していきました。しかし、これらシステムにも、未だ改善すべき大きな弱点がありました。
NU Research:
“弱点”とはどんなことでしょうか?
多田教授:
とにかく作業に手間がかかるのです。
遺伝子のクローニング方法をご存知でしょうか? 特定の遺伝子配列を単離し、増幅することをクローニングといいますが、この作業には大腸菌が用いられています。分かりやすくお話すると、大腸菌の中にはプラスミドまたはベクターと呼ばれる “運び屋遺伝子” があり、ここに自分の目的遺伝子を挿入(コンストラクト)して、大腸菌に目的のクローンを増やさせる、ということをします(図3)。
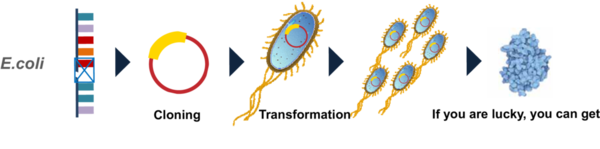 図3. 大腸菌を用いたクローニング法で、タンパク質を合成する
図3. 大腸菌を用いたクローニング法で、タンパク質を合成する
(図は、説明資料として「A Protein Synthesis System 3.0チーム」より提供)
多田教授:
ここで、手間がかかる理由の一つ例を挙げますと、遺伝子の組み合わせを考えるとき、目的に応じるようにして適当なベクターを選択する必要が出てきます。例えば、タンパク質を合成したいときはタンパク質合成用のベクター、遺伝子組み換えなど植物の形質転換を目的とするならば、それ専用の組み換えベクターが必要です。
さらに、1,000種類の異なる遺伝子から1,000種類の異なるタンパク質を合成するには、コンストラクトも1,000種類作らなければなりません。つまり、1,000種類のクローニングが必要となるため、一つ一つやるには莫大な時間と労力がかかってしまうのです。
野元さん:
私の場合、1,500種くらいの遺伝子を対象としていました。クローニングの作業としては、遺伝子1種類あたり1週間くらいの時間がかかります。
さらに言うと、できたタンパク質には、タンパク質間の相互作用を可視化するための目印を付けます(タグ付け)が、タンパク質の両端にあるN末端とC末端の機能を妨げないように、N末端にタグ付けしたものとC末端にタグ付けしたものの二種類のタンパク質(図4)を用意する必要があります。作業時間と労力も単純に倍になるため、正直「やりたくない」気持ちでいっぱいでした。
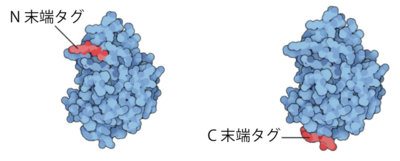 図4. N末端とC末端、それぞれにタグ付けしたタンパク質(図は、説明資料として野元さんより提供)
図4. N末端とC末端、それぞれにタグ付けしたタンパク質(図は、説明資料として野元さんより提供)
タンパク質合成の新システム開発へ
NU Research:
それを克服するかのようにして、新システム「Protein Synthesis System (PSS)」が構築されていったのですね。
野元さん:
「タンパク質合成はこうしないといけない」というような、これまでの概念を捨てた新システムとしてPSSを立ち上げました。PSSは、これまでの煩雑なクローニングステップを経ずとも、ダイレクトにタンパク質が作られる技術です(図5)。
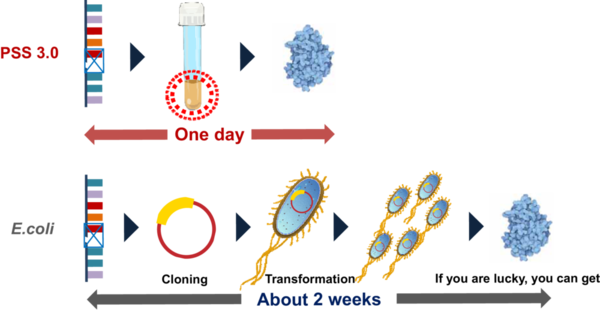 図5. タンパク質合成システムの概略図。PSS(上)および、従来のクローニング法(下)
図5. タンパク質合成システムの概略図。PSS(上)および、従来のクローニング法(下)
(図は、説明資料として「A Protein Synthesis System 3.0チーム」より提供)
NU Research:
どのように世界中の研究者らに紹介していったのですか?
野元さん:
基本的にPSSは自分の研究テーマのために作った合成システムなのですが、学会で研究成果を発表した際、「そのタンパク質はどこから持ってきたの?」と実験方法に興味を示して頂いたことが発端となっています。
・・正直なことを言うと、学会で発表した際、私の研究成果より実験系についての質問ばかりで、植物の自然免疫を研究している者として少し悲しかったですが・・。しかし同時に、私もこの実験系についての反響で初めて「みんなも困っていたんだ」と知ることになりました。
その後、口コミなどで広まり、世界中の研究者らの研究テーマに私が実験を担当する形で参入し、共同研究として成果を出し続けています(論文リスト参照)。
 論文リスト:
論文リスト:
1. Saleh and Withers, et al., 2015, CELL HOST MICROBE
2. Hayami, et al., 2015, PLANT PHYSIOL
3. Kobayashi, et al., 2015, EMBO J
4. Matsuo, et al., 2015, MOL PLANT
5. Tokizawa, et al., 2015, PLANT PHYSIOL
6. Kneeshaw, et al., 2014, MOL CELL
7. Yoshida, et al., 2014, PNAS
8. Takemiya, et al., 2013, NAT COMMUN
9. Yamaguchi, et al., 2013, CELL HOST MICROBE
10. Fu, et al., 2012, NATURE
and more coming!
NU Research:
学会や共同研究を機に、視野を広げることができたという感覚もありそうですね。
野元さん:
共同研究をすることで見えてきたのですが、これまではこの遺伝子が重要だということが分かっていても、そのタンパク質を見たこともなく、取り扱うこともできなかったものも多くあります。このため、実験を中断せざるを得なかったわけですが、「それができるようになった」と喜びの声を頂いています。
また、共同研究を進めていく上で、実験操作について意見交換を持つことができました。頂いたご意見は勉強になることばかりで、PSSの進化にもつなげています。結果として、担当させて頂いた実験データや経験は、データベースとして蓄積し、カタログ化しています。今後、PSSをもっと自由にアクセスして使えるよう「販売して欲しい」という声も頂くようになりました。
PSS 3.0の商品化・サービス化に向けて
NU Research:
NEDO Technology Commercialization Program(TCP)では、市場規模も想定したプレゼンがなされたと思いますが、本システムの商品化・サービス化で、どのくらい期待できそうですか?
多田教授:
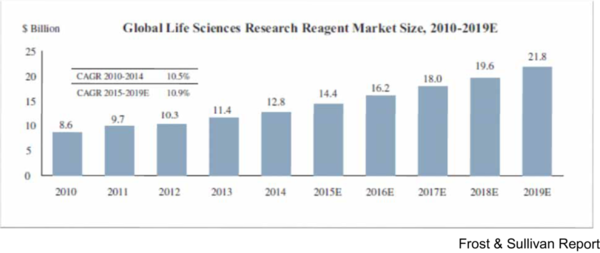
A Protein Synthesis System 3.0チームメンバーの南さんと福田さんに市場について調べて頂きましたところ、市場の規模はグラフ1のようになるそうです。それともう一つ、この実験系はこれまでのクローニング方法とは全く異なる方法であるため、高確率でタンパク質合成を成功させることができます。極めて困難だと言われている膜タンパク質の合成もうまくいくため、その場合を含めた市場の規模はグラフ2のようになるそうです。
グラフ1. タンパク質合成キットの市場規模 TAM=$0.7B と算出される。※TAM=Total Available Market
(出典:Frost & Sullivan Report)
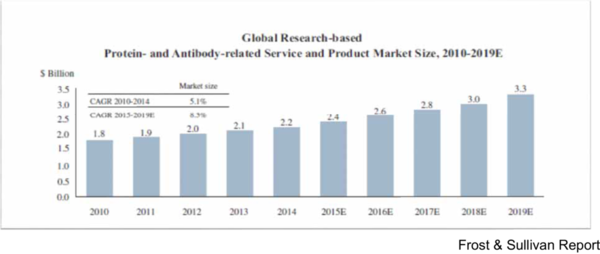 グラフ2. タンパク質および抗体作製サービスの市場規模 TAM=$2.4B と算出される。
グラフ2. タンパク質および抗体作製サービスの市場規模 TAM=$2.4B と算出される。
(出典:Frost & Sullivan Report)
NU Research:
なるほど、実験・研究環境にイノベーションが期待できる、というわけですね。
最後に、今後の取り組みなど、将来への思いをお聞かせください。
野元さん:
正直、PSSの開発は簡単ではなかったです。様々な条件設定に対して忍耐強く一つずつ試していかなければなりませんでした。しかし、タンパク質がうっすらとバンドとして存在感を示したとき(図6)は、「この方法で間違っていなかったのかな」という思いを支えに、挑戦し続けることができました。
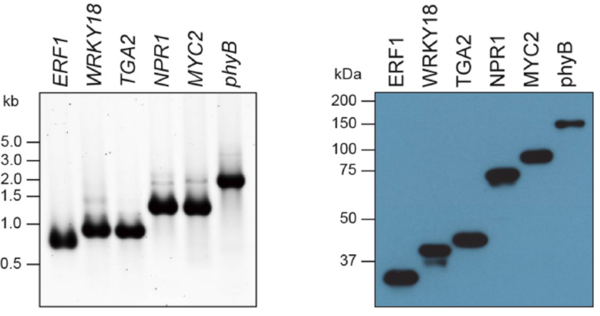 図6. PCR法により、タンパク質の存在を確認(図は、説明資料として野元さんより提供)
図6. PCR法により、タンパク質の存在を確認(図は、説明資料として野元さんより提供)
野元さん:
この度、特にPSS 3.0を構築することで、世界中の研究者と共同研究できる機会を頂くことができましたし、私自身の研究テーマにおいても、NPR1に作用するタンパク質を沢山見つけることができました。
ベンチャー創業については、書類作成をはじめ、全て南さんと福田さんにお任せしており、TCPで最優秀賞として表彰されるまでは「何がすごいのか」あまり実感が沸かなかったです。しかし、これを機に、私の思いにも責任感が生まれてきました。今後、植物病理学の研究者として、またPSS開発責任者としての両方の立場で、一生懸命に挑戦し続けていきたいと思っています。
情報リンク集
- 名古屋大学 遺伝子実験施設 HP https://www.gene.nagoya-u.ac.jp/
- 名古屋大学理学部・大学院理学研究科 多元数理科学研究科 HP http://www.sci.nagoya-u.ac.jp/
- 名古屋大学 学術研究・産学官連携推進本部 HP http://www.aip.nagoya-u.ac.jp/